座談会「うつ病の解明について、この10年を振り返り、次の10年を見据える」
ルンドベック社が本社を置くデンマークは精神科医療の向上に力を入れており、日本をはじめ世界における動向を注視しています。過日に開催されたデンマーク王国大使館との共催の座談会の場で、日本におけるリーダー的役割を担う3人の先生方に、これまでのうつ病研究の足跡を振り返っていただくとともに、これからの研究の方向性について語っていただきました。
岩田 仲生 先生
(司会・藤田医科大学医学部 精神神経科学講座 教授/写真中央)
馬場 元 先生
(順天堂大学大学院 医学研究科 精神・行動科学 教授/写真右)
加藤 正樹 先生
(関西医科大学医学部医学科 精神神経科学講座 教授/写真左)
第1部 Presentation
岩田 「うつ病の解明について、この10年を振り返り、次の10年を見据える」のテーマで議論していきましょう。まず、馬場先生と加藤先生が長年にわたる研究の中で、それぞれうつ病をどう捉えてきたか、そのうえで今後の研究の方向性はどうあるべきかについてご紹介ください。
「研究から得られた因子が真のバイオマーカーになり得るかが大きな課題」
(馬場 元 先生)
馬場 まず、うつ病のメカニズムについての私の理解を説明します(図1)。うつ病にはそもそも遺伝的な素因があり(①)、その遺伝的な素因が、特に幼少期の環境要因が加わって引き起こされるゲノム上のエピジェネティックな修飾によって遺伝子発現に違いをきたします(②)。この遺伝子発現の違いが神経の可塑性などを変化させることで神経ネットワークに何らかの影響を及ぼします(③)。この結果、脳に何らかの変化が起きて、まだうつ病が発症していない段階で、エンドフェノタイプ、パーソナリティ、社会的認知、行動特性などに変化をきたしていきます(④)。この段階でストレス脆弱性が形成されていると、そこにストレスが加わりうつ病発症に至る(⑤)、という流れです。
これからの研究の方向性としては、ゲノム研究や画像診断などで得られた候補遺伝子やリスク因子などのさまざまなファクターについてAIなどを用いてダイナミックに組み合わせて解析することで、より精度の高い疾患分類が可能になると考えており、鑑別診断にも貢献するでしょう。ただし、こうした研究から得られた因子が真のバイオマーカーになり得るかが大きな課題です。うつ病は病相(ステート)が大きく変わる疾患です。うつ病患者と健常者の違いを検討したこれまでの検討は、言わばうつ病発症者と非発症者の比較であり、非発症者の中にも発症前段階にある人が相当数いることで、極端な話、健康診断でうつ病のリスク因子が同定できるようになったとしても、うつ病患者と同じ生物学的背景を持つ健常者が抽出されるだけでは真の意味で診断マーカーにはなり得ません。逆にうつ病のリスク因子ではなく、ステートの変化を拾ってしまっている可能性もあります。
他の疾患、たとえば認知症は、まずバイオマーカーによる鑑別診断があり、ステートは診断による後付けです。脳内にアミロイドβの沈着などがあれば「アルツハイマー病」の病名が付けられ、認知機能の低下が認められれば「アルツハイマー病による認知症」と上乗せされるわけです。変性疾患と機能性疾患を同列に論じることにはやや無理があるのですが、ある程度信頼できるバイオマーカーが出てきたら、「○○うつ病」などと先に名前を付けておき、その後に後付けしていくやり方のほうが本来、生物学的に疾患を診るうえでは合理的ではないかと考えています。
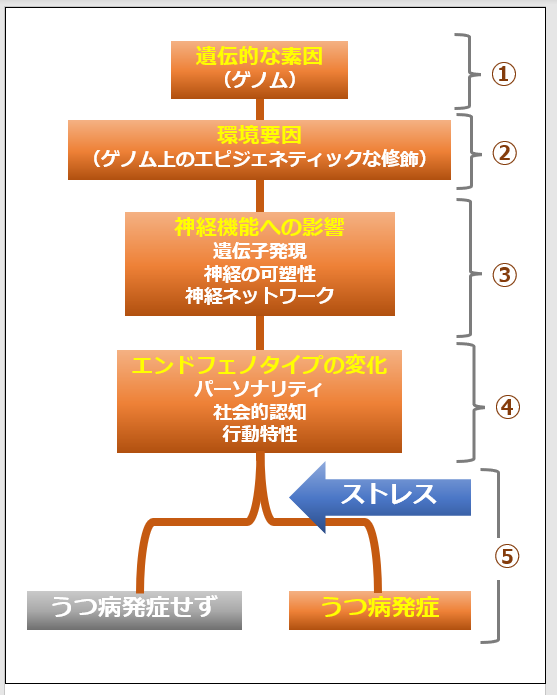
図1 うつ病発症機序(馬場先生資料より)
「解析の目的を明確にしたうえでGWASによる症例集積を」
(加藤 正樹 先生)
加藤 2003年に参加した第33回日本臨床精神神経薬理学会で私は「薬物動態やトランスポーター、代謝に関わる候補遺伝子について調べることが至適な薬物治療に結びつく」と講演し、ボローニャ大学留学中にも候補遺伝子の研究を続けていました。しかし、「うつ病およびうつ病の治療反応自体が解明されていない中で立てた仮説に基づく候補遺伝子だけを見るのではなく、もっと網羅的に見ていく必要がある」との考えに至りました。これを可能にするゲノムワイド関連解析(GWAS)が登場し、研究が画期的に進んだことはご承知のとおりです。
多くの症例を集積・解析できるGWASですが、環境要因の影響が大きいうつ病ではバイオマーカーを見つけることが難しく、解析の目的がはっきりしないうちに、うつ症状のある人を集めてトップヒット遺伝子を集積・解析してもあまり意味を持ちません。「Nが増えれば真の部分の山が高くなる」との考え方なのでしょうが、うつ病にはおそらくいくつかのサブタイプがあり、いくつかの違う山があるはずです。数を稼ぐために質を犠牲にしかねない「とにかく症例数(N)を多く集めろ」とのアプローチからいったん離れ、なぜこの遺伝子型、このパスウェイ、この症例でこのフェノタイプなのかを理解し、症例を選別したうえでNを集める必要があります。たとえば2型糖尿病や肥満など環境要因の影響を大きく受ける疾患については、人種によって関与している遺伝子が異なることがわかっています1。うつ病についても人種差が関与している可能性があります。
今後の研究の方向性としては、うつ病の中でも、たとえば治療抵抗性を伴う/伴わない、精神病性の特徴を伴う/伴わないなど、明らかに異なる2群を比較して、そこで差が出る遺伝子を見つけて「この患者にはこの薬を使ったほうがよい」と判断したうえで再現性を確認するアプローチが必要になってきます。
「日本発の疾患関連遺伝子の同定/疾患メカニズムの解明のための研究体制を構築中」
(岩田 仲生 先生)
岩田 およそ10年前の精神科医療を振り返ると、当時、主要国のなかでは特に日本の精神疾患と自殺者が大きく増加していました。私は、これだけの増加が生じる原因は環境要因以外にあり得ないと考えたわけです。
うつ病に関連する膨大な環境要因の解明にはコホート研究によるGxE解析(遺伝子型と環境の交互作用)を行うしかありません。我々は看護師を対象としたコホート研究を立ち上げ、いくつかの候補遺伝子を見つけたのですが、健常人が疾患を発症するまで待ち続ける研究はあまりにも効率が悪く、また、全国民でコホート研究を行っている北欧などに太刀打ちできるはずもありません。「介入に対して動く遺伝子を探したほうがよいのでは」との結論に至り、最近では看護師を対象にしたグループCBP(小児行動質問表)による介入の効果を検証したデータを発表しています2。
エフェクトサイズが大きな候補遺伝子の研究はDisrupted-In-Schizophrenia 1(DISC1)などを除けばほぼ不成功に終わっていますが、小さなエフェクトサイズを捉えることが可能なGWASは統合失調症では改めてドパミンD2受容体の関連が「再発見」される3など、大きな成果をもたらしています。我々は現在、GWASで拾ったエフェクトサイズが小さな候補遺伝子のメカニズムについて、光遺伝学なども駆使して解明に取り組んでいます。
また、精神疾患解明について国内外の施設と共同研究体制を構築しており、Psychiatric Genomics Consortium(PGC)という最大級の国際コンソーシアムに参画することで、世界に先駆けて日本発の精神疾患関連遺伝子の同定と、日本人のデータから精神疾患メカニズムの解明を目指しているところです(図2)。
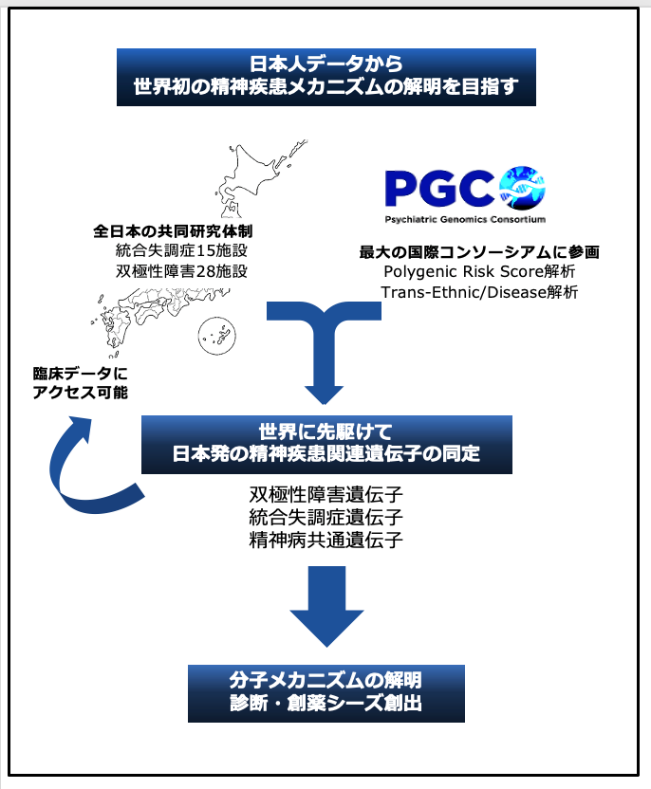
図2 日本発エビデンスを創出するための共同研究体制の構築と将来展望
第2部 Discussion
「うつ病とは何か」の解明に向けて
岩田 今後研究が進む中でうつ病はどう定義されるのか、臨床的特徴に対するエンドフェノタイプ、そして、これからの研究のあるべき方向性について議論していきましょう。まず、うつ病はどう定義づけされるべきかについて、それぞれのお考えをお聞かせください。
加藤 現在はDSM-5(Diagnostic and Statistical Manual of Mental Disorders 5th edition)が精神疾患の分類・診断に用いられていますが、臨床で使用するには十分とは言えません。そこで、まずはDSM-5によりうつ病と判定された患者について、できる限り多くのデータと検体を採り貯め、さまざまなフェノタイプを探索する作業を行うことで、より細分化された新たな定義・指標を作り上げることが合理的で効率よい解明方法なのではと考えています。
一方、糖尿病や睡眠時無呼吸症候群(SAS)、パーキンソン病など身体疾患に併存しているうつ状態については治療反応性が異なることから、身体疾患と同一のパスウェイからうつ病が発症する可能性を検証していく必要があります。
馬場 私は「うつ病を身体因性、内因性、心因性に分類して位置付けたKielholz(1916-1990)にまで遡るべき」と考えています。うつ状態に関連する様々な症状はシンドローム(症候群)として括られて論じられているのであり、こうしたうつ状態に関連する様々な症状を有する患者の中から、本当のうつ病と言える「内因性うつ病」を抽出する作業が必要になってくると思っています。その際に「バイオマーカーで判定できるうつ病」が定義されるようになればさらに研究も進むでしょう。
岩田 加藤先生のお考えに近い、診断スケールを目的に応じて改良・開発していくとのアイディアとしては、日本人における特徴的なうつ病の診断スケールとしてKK分類(笠原・木村分類)があります。また、中国では閉経後の女性のうつは普通のうつと違うとして、閉経後の女性だけにGWASを行っていますね。加藤先生もまた高齢者のうつについて取り組んでおられます。
それぞれの研究をどうリンクさせて診断・治療につなげるか
岩田 次に、うつ病の臨床症状と、今後進むエンドフェノタイプ研究とバイオマーカー研究などをどうつなげて診断と治療に結び付けていくかについて、先生方のアイディアをお聞かせください。
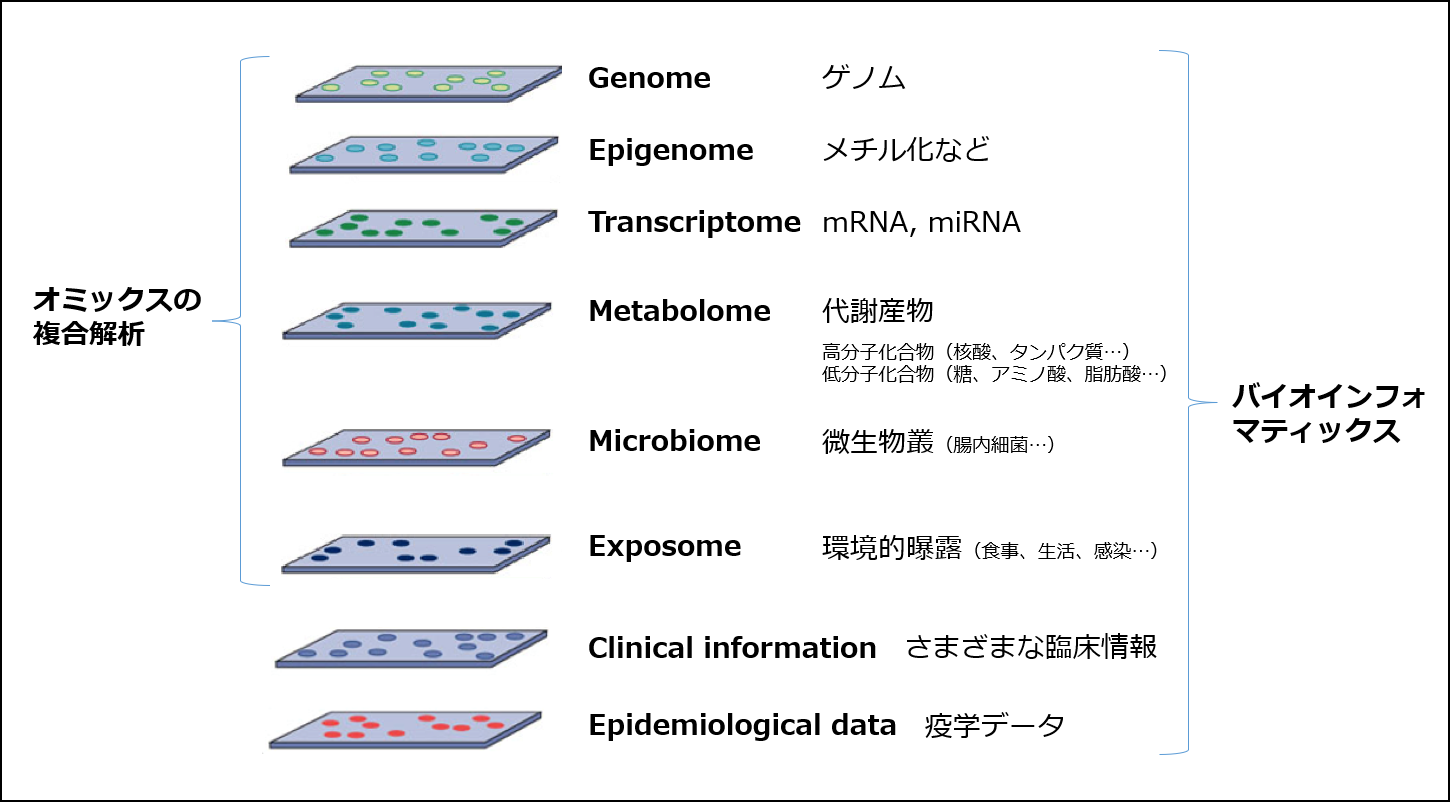
加藤 私が取り組んでいるのは「個々の患者にどう介入したらよいか」を探るprecision medicineです。抗うつ薬の投与や環境調整のみならず、うつ病発症のあらゆる経路を解明して、たとえば糖尿病患者ではインスリン抵抗性や免疫反応を改善することで併発したうつ病も改善するかを見定めるような方法を考えています(図3)4。有望なバイオマーカーを発見するとともに、それだけではなく、何らかの介入と治療へつなげなければなりません。
また、たとえばハミルトンうつ病評価尺度(HAM-D)の6点、7点、8点では何が違うのかなど、改善の定義も繊細に見ていく必要があります。目指す目標は何か、復職なのか元のレベルまでに戻すことなのかに応じて設定できる評価スケールが必要です。この点で、Goal Attainment Scale for Depression(GAS-D)5など、それぞれの患者の目標に応じた改善度を評価できる興味深い評価スケールが出てきています。簡便に記載できる評価スケールと、バイオマーカーやゲノムの関係を丁寧に見ていく作業が必要です。
馬場 うつ病は改善・寛解することが他の精神疾患と大きく違います。統合失調症や認知症などは生涯にわたる診断となりますが、30歳代でうつ病と診断され、半年後に改善して70歳代まで寛解を維持している人を「うつ病で現在は寛解状態」と呼ぶべきでしょうか。発症と改善の「縦軸の動き」がある疾患ではこれが難しい課題になります。
バイオマーカー研究においても、これまではうつ病患者と健常者またはその他の精神疾患患者を横断的に見ていたのですが、健常者がうつ病を発症するまでの「縦軸の動き」が重要であり、残念ながら現段階のバイオマーカー研究の限界と言えます。うつ病と呼ばれるシンドロームをターゲットにしている限りはバイオマーカーを見つけることは難しく、さらに層別化し、厳格なカテゴリー分類を行うことが必要です。
これからの10年間の研究課題について
岩田 最後に、うつ病の解明と治療の進展のために、今後10年間で何を為すべきか、一言ずつお聞きしたいと思います。
加藤 データサイエンスやAIは大きく進化し、かつては膨大な時間をかけていたシークエンシングにもほとんど時間をかけずに行うことができるようになりました。しかし、テクノロジーがいくら進化しても臨床データと検体が簡単に集積できるわけではありません。我々がやるべきことは、まずは臨床データと検体を丁寧に集めることです。治療の内容と各種の評価スケールにおける改善度、副作用、社会機能について長期間見たデータと血液などの検体を集積しつつ、時代に応じて継続して測定していくことで何かがわかるかもしれません。自施設での解析が難しければ新しい視点と技術を持つ研究者にデータを手渡す準備をしておけばよいと考えています。
馬場 Research Domain Criteria(RDoC)の試みもありますが、私は、これまでのうつ病をはじめとした精神疾患の診断基準について大幅な改革がなされることを期待しています。勇気ある研究者が従来の診断基準とは異なる精神疾患のカテゴリーを生物学的に再構築し提案していくことがこれからの10年間で重要になってくるでしょう。
岩田 ありがとうございます。うつ病の解明は実に難しいのですが、研究者には苦しんでいる患者さんのために成果を出す責務があります。研究のための研究ではなく、患者さんに還元できる研究を進めていく精神科医として頑張っていくことを誓って本座談会を終了いたします。馬場先生、加藤先生、本日はありがとうございました。
※図をクリックすると拡大表示されます。
図3 加藤先生が考えるオミックスベースのうつ病とprecision medicineの概念
「エピゲノムやトランススクリプトーム、プロテオームなどの因子を網羅的に解析するオミックス解析では臨床的な表現型のみならず、社会的・行動的な多様な表現型や脳機能画像などと組み合わせたデータの抽出と、その膨大なデータについてAIを用いた解析が進んでいくだろう」(加藤正樹先生)3
座談会取材、撮影:ルンドベック・ジャパン Progress in Mind Japan RC
取材日:2021年7月28日
場所:駐日デンマーク王国大使館(東京都渋谷区)