うつ病の維持期治療 ~患者さんの声とともにリカバリーの課題について考える~【学会共催シンポジウム】
座長/馬場 元 先生
(順天堂大学医学部附属順天堂越谷病院メンタルクリニック)
座長・演者/稲田 健 先生
(北里大学医学部 精神科学)
演者/菊地 俊暁 先生
(慶應義塾大学医学部 精神・神経科学教室)
演者/林 晋吾 氏
(株式会社ベータトリップ)
演者/堀 輝 先生
(福岡大学医学部 精神医学教室)
【講演1】うつ病のリカバリー概論:ポジティブな感覚を持つ意味とは
演者:菊地 俊暁 先生(慶應義塾大学医学部精神・神経科学教室)
リカバリーの概念
リカバリーとは、症状の改善や寛解に留まらず、⽣活機能や個⼈の価値観に基づいた幸福感の向上を⽬指す広範な概念である。特に近年では、「機能回復(Functional Recovery)」に加え1、患者の⽣活の質向上を⽬的とした「Personal Recovery」や「Social Recovery」が重要視されている2,3。⼀⽅で、リカバリーという⾔葉が抽象的に使⽤され、具体性に⽋ける問題も指摘されている。本来リカバリーは、患者個⼈の価値観や⽬標に基づく多様な変化のプロセスを表し、それが患者の幸福感や満⾜感に直結する4。⽀援者や医療者が押し付けるものでないことを注意したい。
リカバリーの状態を評価する際に重要な要素が、Leamyらが提唱したCHIMEモデルである5。このモデルは、「つながり(Connectedness)」「希望と楽観主義(Hope and Optimism)」「⾃⼰認識(Identity)」「意味付け(Meaning)」「エンパワーメント(Empowerment)」の五つの要素から構成され、ここに⽇本独⾃の⽂化や価値観を反映することで、⾃分らしさを取り戻す際の指標となる。こういった幸福感やポジティブな感情が重要である⼀⽅、ネガティブな感情や葛藤も成⻑や回復にとって意味のある経験として認識されている。ポジティブ、ネガティブな感情を含めた幅広い感情の動きを尊重することがリカバリーには不可⽋である。
Emotional Bluntingとその治療
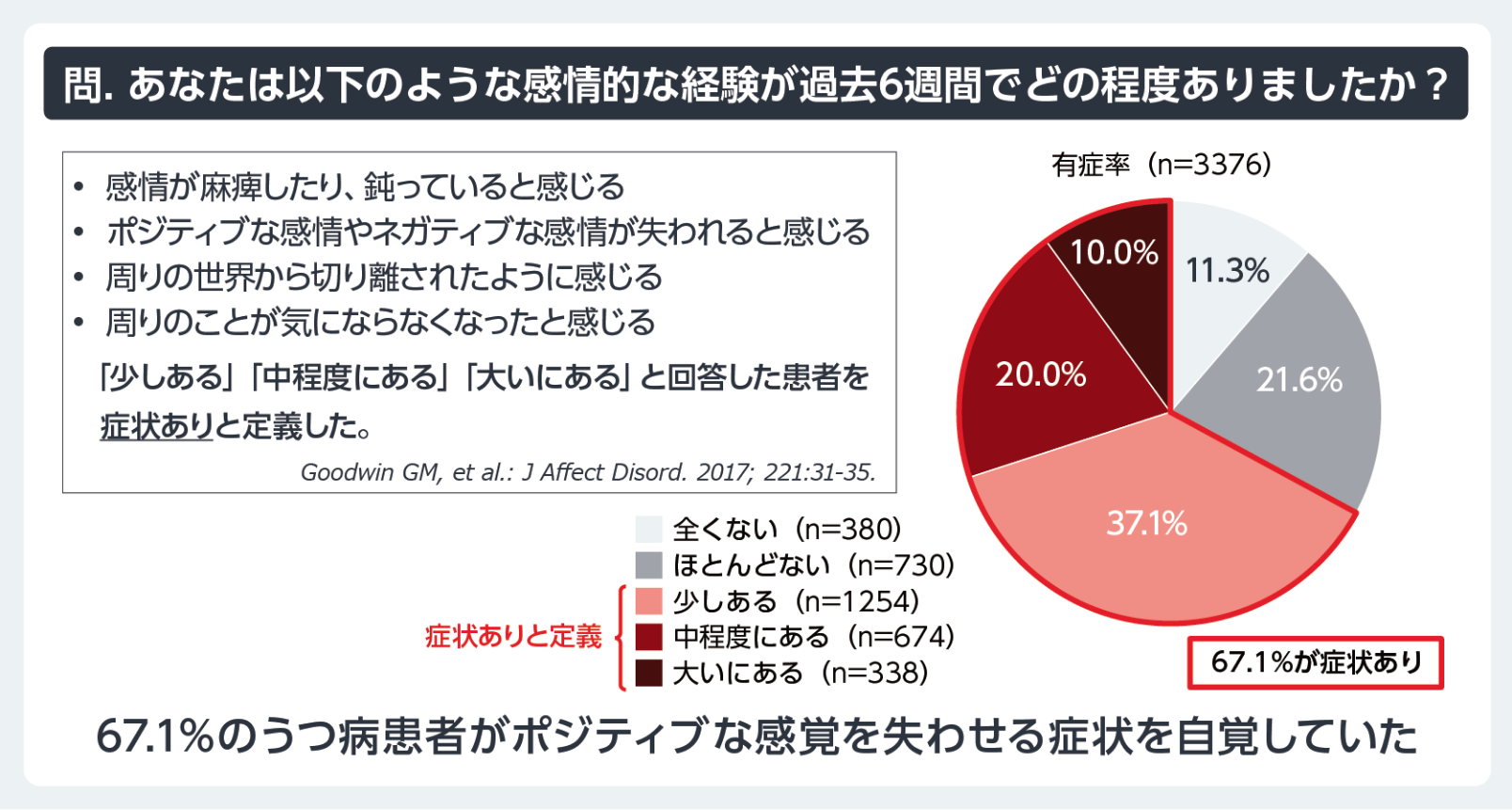
感情の⿇痺(Emotional Blunting)はリカバリーを妨げる重要な課題である。この状態は、ポジティブ、ネガティブの双⽅の感情を失い、感情の平坦化を引き起こす。⽇本国内の調査によると、対象となったうつ病患者の67.1%がこの状態を経験している6(図1)。 Emotional Bluntingは抗うつ薬の副作⽤や抑うつ症状⾃体が原因である可能性があり7、患者の⽣活の質や社会的関係に悪影響を及ぼしている8-10。この問題を解決するためには、治療⽅針の修正や薬剤調整だけでなく、感情を動かす機会を治療に取り⼊れることが求められる。
その具体例として、リカバリー志向型認知⾏動療法(CT-R)の適応モードが注⽬される11。このアプローチは、患者の価値観や⽬標を中⼼に据え、感情が動く瞬間やポジティブな体験を通じて患者⾃⾝の⼒を引き出すことを⽬指す。医療モデルがネガティブな感情や嫌な体験を減らすことに焦点を当てるのに対し、適応モードはポジティブな側⾯を強化することに重点を置いている。また、その核となる「アスピレーション」は、患者の切望や希望を表すが、必ずしも具体的である必要はない。漠然とした期待や⽇々の⼩さな願望、そこに⾏き着く過程もアスピレーションの⼀部となる。適応モードを通じて、患者は⾃分のアスピレーションを明確にし、それに向かってポジティブな感情を強化することができる。
また、治療者が姿勢を変えることも必要である。患者の強みや価値観に焦点をあて、これらを治療に取り込むことで患者との関係性を深めることが期待される。
リカバリーはゴールではなく、個々の価値観や感情に根ざしたプロセスと捉えるべきであり、⾃分らしさを取り戻す過程がその本質である。
図1 ⽇本におけるEmotional Bluntingに関する実態調査
6)Kikuchi T, et al.: Neuropsychopharmacol Rep.2024; 44(2): 321-332.
本研究は武⽥薬品⼯業株式会社及びLundbeck社の資⾦により⾏われ、著者には武⽥薬品⼯業およびLundbeck社の社員が含まれる
【講演2】うつ病患者の回復と家族の視点 ~残遺症状とEmotional Blunting の理解~
演者:林 晋吾 氏(株式会社ベータトリップ)
維持期における残遺症状の経験
演者は2010年にパニック障害を発症し、その後うつ病と診断された。再発を繰り返す中で寛解を達成し、現在はメンタル不調を抱える⼈々やその家族を⽀援するコミュニティサイト「encourage」を運営している12。本講演では、患者と家族の視点から残遺症状やEmotional Blunting(感情の⿇痺)の影響とその⽀援策が紹介された。
演者は、うつ病寛解後も倦怠感や気分の落ち込み、集中⼒の低下に悩まされた経験を共有した。わずかな活動でエネルギーを消耗する感覚や、何も楽しく感じられない状態が⻑らく続いた。仕事においても簡単なタスクに過剰な時間を要し、⽣産性が著しく低下した。この結果、⾃責の念が⽣じながらも相談できず、孤⽴感が深まった。
その残遺症状の⼀つが感情の⿇痺(Emotional Blunting)である。⾃然な感情が湧かず、物事や他者への興味が薄れる問題であった。これにより社会的な繋がりが失われ、無価値な存在と感じることがあった。この感覚の⾔語化は難しく、医師への相談を断念していたが、振り返ると違和感を早期に医師へ伝えれば良かったと感じている(図2)。
これらの残遺症状の回復には数年単位の時間を要した。回復の鍵を握っていたのは、規則正しい睡眠、バランスの取れた⾷⽣活、適度な運動、無理のない⽣活リズムを維持することであった。これにより、徐々に意欲が回復し、⼈との交流や新たな挑戦への意欲が戻ってきた。これらの経験を通して、患者⾃⾝が違和感に早期に気づき、適切に対処する能⼒を養うことが重要であると強調した。
Emotional Bluntingは患者⾃⾝だけでなく、家族にも影響を及ぼす⼤きな課題である。家族とのコミュニケーションでも⼼が動かず、会話が減るといった経験を語った。Emotional Bluntingは表情や反応の乏しさとして周囲に伝わりやすく、家族の孤⽴感や疎外感も増幅させる原因となる。実際に患者家族のコミュニティサイトでは「会話の減少」「趣味や⼈間関係の疎遠化」「⾃分への関⼼が失われたように感じる」といった声が寄せられており、家族側も⼤きな⼾惑いや無⼒感を抱える要因になっている。この背景には、Emotional Bluntingが疾患の⼀部であるとの認識不⾜や、適切な接し⽅に関する理解の不⾜が含まれると考えられる。
図2 Emotional Bluntingの経験
林 晋吾 ⽒ 作成
残遺症状やEmotional Bluntingに対する対応
こうした課題に向けて⼆つの⽀援策を挙げた。⼀つ⽬は、情報提供の充実である。残遺症状やEmotional Bluntingを疾患の⼀部として正しく理解することで、患者や家族が回復プロセスに対する認識を深められる。診療時の具体的な説明、パンフレットやウェブサイトを通じた情報発信が求められる。⼆つ⽬は、患者が気軽に⾃⾝の感情や症状について話せる環境を整備することである。診療時に医師が「以前ほど関⼼を持てなくなったこと」を問いかけることで、患者が⾃⾝の状態を理解しやすくなる。このようなサポートを通じて、患者が安⼼して話せる場を提供できると考えられる。
うつ病の維持期に⾒られる残遺症状やEmotional Bluntingは、患者本⼈のみならず、その家族にも多⼤な影響を与える。このため、患者と家族がこれを理解し、医師と協⼒して適切な⽀援を⾏う環境を構築することが、回復への重要な⼀歩であると結論付けた。
【講演3】患者さんと共に考えるリカバリー
〜Decision Aid、評価尺度、資材を有効に活⽤するための⼯夫〜
演者:堀 輝 先⽣(福岡⼤学医学部 精神医学教室)
SDMの実現を補助する Decision Aids
近年のうつ病治療では、Patient Centered Careや、Shared Decision Making(SDM)といった概念が重視されている。⽇本うつ病学会はSDMを推進するため「治療法を⼀緒に選ぶための⼿引き」といったDecision Aidを作成し、学会ホームページに資料を掲載している13。この⼿引きには、うつ病の特徴、治療に関してよくある質問、患者が重視したいポイントの整理表などが含まれており、患者と疾患について知り、治療に関して意思決定を行う際に活⽤されることが期待される(図3)。
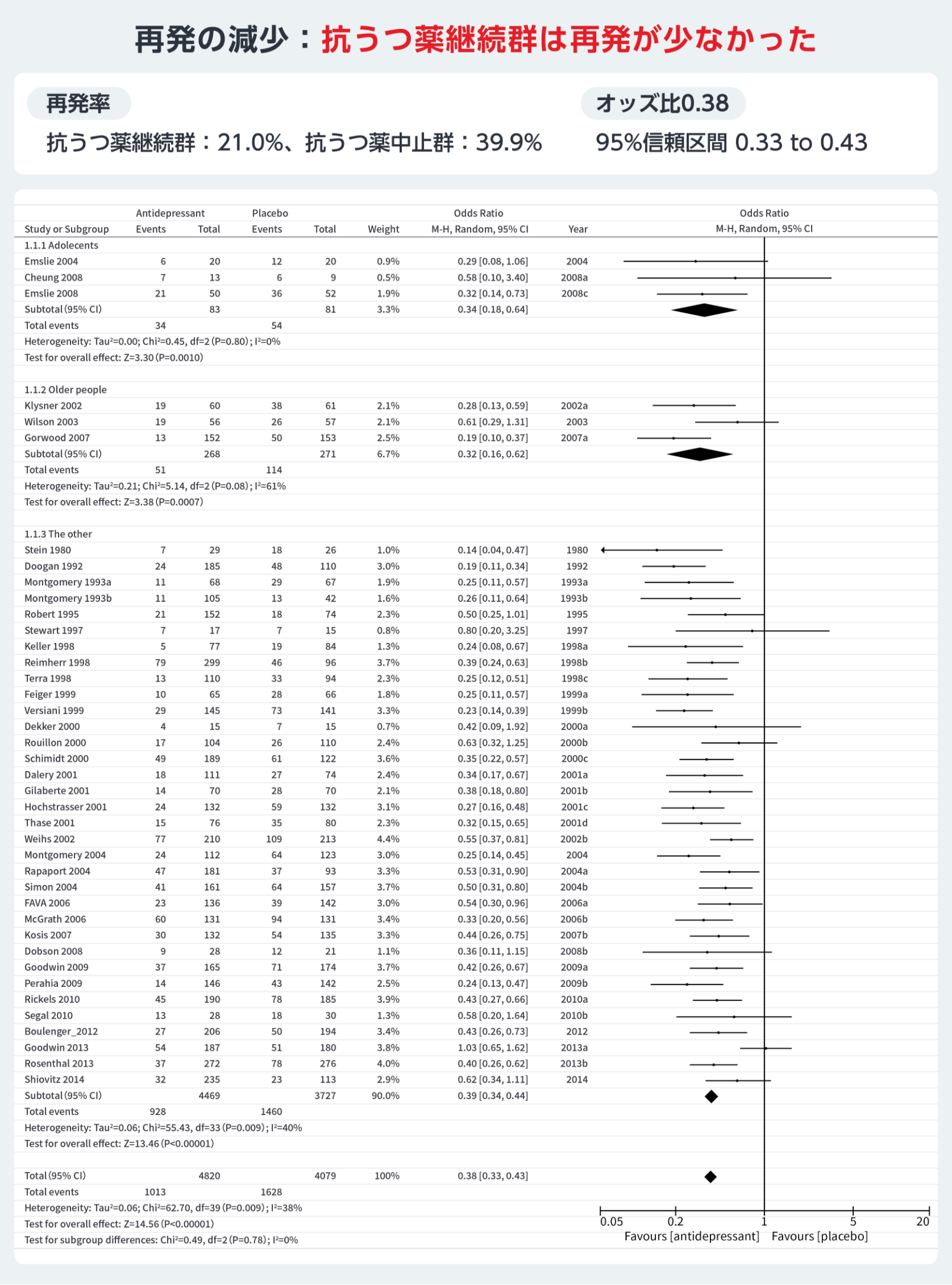
維持期治療における抗うつ薬継続の有用性に関しては、抗うつ薬の継続に関するメタ解析では、寛解したうつ病患者において、抗うつ薬継続群は中⽌群と⽐較して、低い再発率が⽰された14。この結果の解釈は、抗うつ薬をたとえ継続したとしても約2割は再発する、抗うつ薬を中⽌しても6割は再発しないといった異なる捉え⽅ができる。
このメタ解析の結果を基に作成された「抗うつ薬の使⽤を継続する/中⽌する ⼀緒に決めるための⼿引き」では、継続と中⽌の⻑所・短所がまとめられている15。先ほどのメタ解析のデータの解釈には、患者の価値観なども影響するために、それらの患者の訴えに耳を傾けることが必要となる。このDecision Aidでは、継続した場合は再発リスクが減少するが、副作⽤のリスクや服薬の⼿間が⽣じることや、中⽌した場合は薬を飲む必要がなくなるが、再発のリスクがやや⾼まることなどが記載されている。これらの情報を基に、患者が何を重視するかを整理し、医師と患者が共に治療⽅針を決定するプロセスが重要である。
患者の症状を把握するための評価スケール
患者中⼼の医療を推進するうえで、Patient Reported Outcome(PRO)の活⽤は不可⽋である。患者の主観的な症状や⽣活の質を評価し、治療効果を包括的に把握することは、患者中⼼の医療の推進に繋がる。また、評価結果を患者と共有することで、治療⽅針の協議が進みやすくなる。実臨床に応用しやすい尺度として、HAM-Dと相関が強いと言われているQIDS-Jを使⽤する16ことで、治療効果を把握しやすくなり、薬物調整の参考につながる可能性がある。
また、うつ病の症状に加えて、社会的適応度や認知機能の評価も重要である。例えば、SASSはうつ病患者の社会適応度の評価に利⽤され、31点以上で復職成功の可能性が⾼いといった報告もある17。また、THINC-it®のような簡便な認知機能評価ツールを活⽤18し、主観・客観双⽅の評価を実施することも重要である。加えて、睡眠・覚醒リズム表19の活⽤により患者の睡眠状況を詳細に把握することや、⽬標達成尺度(GAS-D)20を通じて個別の治療⽬標を設定する取り組みも効果的だと考えられる。いずれの場合も評価するだけでは不⼗分であり、評価結果を患者に共有し、治療やケアに活かすことが重要である。
さらに、電⼦媒体の活⽤も注⽬されている。⽇本初のelectronic PRO(ePRO)を活⽤した「J-SUPPORT」研究では、症状評価を含む全プロセスがオンラインで完結する仕組みが試みられた21。ePROは、作業負担の軽減に寄与すると期待される。
資材や評価尺度の作成にとどまらず、それらを活⽤し患者とのコミュニケーションを促進することが、維持期における患者のリカバリーを⽀援する鍵となる。
QIDS-J:Quick Inventory of Depressive Symptomatology
SASS:Social Adaptation Self-evaluation Scale
THINC-it®:THINC-integrated tool
GAS-D:Goal Attainment Scale for Depression
図3 活⽤できる資材‧評価尺度について13,19,22
13) ⽇本うつ病学会:治療法を⼀緒に選ぶための⼿引き(Decision Aid for Depression Treatment)(https://www.secretariat.ne.jp/jsmd/iinkai/katsudou/data/psychoeducation… :アクセス⽇:2025/09/03)
19) ⽇本うつ病学会:睡眠‧覚醒リズム表(https://www.secretariat.ne.jp/jsmd/gakkai/shiryo/data/suimin_kakusei_rh… :アクセス⽇:2025/09/03)
22)SASS-J ⾃記式社会適応度評価尺:原著者:Marc Bosc, Adriana Dubini, Valérie Polin、
日本版構成:中村 純、樋口 輝彦
(画像:心理検査出版 三京房 https://www.sankyobo.co.jp/SASS-J.html :アクセス日:2025/10/15)
【講演4】維持期治療におけるうつ病診療 〜改訂版ガイドラインの観点から〜
演者:稲⽥ 健 先⽣ (北⾥⼤学医学部 精神科学)
維持期の定義と治療⽬標
うつ病治療ガイドラインの改訂において「維持期」の定義付けが議論された。うつ病は何らかの症状による機能⽔準の低下を契機に急性期治療が開始され、徐々に回復して寛解に⾄る。寛解はDSM-5の定義に基づき、部分寛解と完全寛解に分けられる23。部分寛解は症状の残存はあるが診断基準を満たさない状態、または抑うつエピソード終了後に重⼤な症状がない期間が2カ⽉未満の状態を指し、完全寛解は過去2カ⽉間に障害の重⼤な兆候が⾒られない状態である。改訂ガイドラインでは、DSM-5を参照しても曖昧な点は残るものの、概ね寛解した後を維持期として整理した。
うつ病治療の⽬標についても議論されたが、既存の研究は症状評価が主であり、症状改善後の姿が治療⽬標となることは少ない。維持期治療の⽬標は、再発を予防しながら社会機能を回復することである。私⾒としては、患者が病前の状態より⾼い⽔準を⽬指す治療が必要だと考える。以前、患者から「10年過ぎて初めて好奇⼼が戻ってきた」と⾔われ、医師から⾒て症状や社会的機能が良好に⾒えても患者は⼀歩先のリカバリーを求めていたことに気付かされた。⼀⽅でガイドラインではリカバリーの定義は統⼀されていないため、多様なリカバリー像に対し、患者と⽬標を共有しながら治療⽅針を協議することが重要である。
維持期の治療課題
維持期治療における最重要課題は再発防⽌である。再発は患者に苦痛を与え、回復を妨げ、更なる再発リスクを⾼める24。研究によると、医療機関での追跡調査では6カ⽉で14.4%25、1年で21〜37%26,27、15年で85%27が再発している。⼀⽅、地域社会での調査では、20年間で27〜45%の再発が⽰されている28。特に寛解後1年⽬の再発リスクは⾼く、その後徐々に低下するため、早期の再発防⽌が重要である(表1)。
再発リスク因⼦には、うつ病の症状残存や⼩児期の被虐待経験、重症度や再発回数、社会的⽀援不⾜、ストレス多いライフイベント、寛解期間の短さ等が挙げられる23,29,30。リスク因⼦の中には介⼊可能な要素もあり、対応が求められる。
維持期の治療
維持期治療では、薬物療法の継続、認知⾏動療法を基盤とした精神療法の追加、ニューロモデュレーション治療の継続が挙げられる。薬物療法の継続には再発率低下を⽀持する報告があり、継続群で再発率が約20%、中⽌群では約40%とされる14。寛解後少なくとも6カ⽉間は抗うつ薬継続が推奨されている31。
精神療法では、認知⾏動療法を抗うつ薬と併⽤することで、再発を減少させる報告がある。ただし⽇本では認知⾏動療法のリソース不⾜が課題であり、ガイドラインでは「提案」に留まる。
リハビリテーションも重要で、⼼理教育、作業療法、デイケア、就労⽀援プログラム、ピアサポートグループ等が挙げられる。特にリワークデイケアは、効果的なプログラムが確認されている。また認知⾏動療法以外の⼼理社会的治療のエビデンス創出も今後の課題である。
治療の⽅向性を共有するためにはSDM(Shared Decision Making)の重要性が論じられている。患者との⽬標共有には、近年MBC(Measurement-Based Care)が重視されており、改訂ガイドラインの⼤きな特徴である。
抗うつ薬の選択においては副作⽤も重要で、モノアミンとの関連が指摘されている32,33。治療効果と副作⽤のバランスを考え、治療継続性を最⼤限考慮する姿勢が求められる。
表1 維持期における治療継続の重要性(抗うつ薬の継続)
14) Kato M, et al.: Mol Psychiatry.2021; 26(1): 118-133.
【パネルディスカッション】
患者側と医療者側から⾒る「うつ病維持期」の患者の負担と治療課題
座⻑:順天堂⼤学医学部附属順天堂越⾕病院メンタルクリニック 教授 ⾺場 元 先⽣
パネリスト:北⾥⼤学医学部 精神科学 主任教授 稲⽥ 健 先⽣
パネリスト:慶應義塾⼤学医学部 精神‧神経科学教室 准教授 菊地 俊暁 先⽣
パネリスト:株式会社ベータトリップ 代表取締役 林 晋吾 ⽒
パネリスト:福岡⼤学医学部 精神医学教室 教授 堀 輝 先⽣
医師が把握していない残遺症状にどう対応するか
馬場先生
患者さんが感じている残遺症状の把握を医療者がどのように進めるべきか、皆さんに考えをお聞きします。
林氏
残遺症状を医師が把握していない場合、対応策として⼆つのポイントがあると思います。⼀つ⽬は、患者⾃⾝が残遺症状を抱えていて苦しんでいるものの、医師にどう相談して良いか分からず、⾔葉にできないケースです。
こうした場合、医師が治療の場で情報を提供しながら、患者が⾃らの症状を⾔語化するサポートをすることが⾮常に有効だと感じます。
⼆つ⽬は、特に維持期において、患者⾃⾝が残遺症状を⾒過ごしてしまうことです。私⾃⾝も維持期には、元の⽣活に戻ることを優先して、多少の不調や違和感があっても無視していました。ただ、家族や周囲の⼈々はその違和感に気付いているケースも多いと思います。そのため、医師が家族や周囲の⽅からの情報を取り⼊れることが、診察の場だけでは難しい患者の状態把握に役⽴つのではないかと考えます。
菊地先生
医師が残遺症状を把握できていない場合、その原因が医師⾃⾝の⾒落としなのか、それとも患者さんが伝えにくい状況にあるのかを考える必要があります。患者さんが⾃⾝の症状をうまく⾔葉にできない場合、私たち医師がフレームワークを⽤意するなどして、症状を具体化する⼯夫が求められます。例えば、ODQ-JのようなPROの尺度を活⽤し、「こういう症状がありますか?」と尋ねることで、患者さんに症状の存在を認識してもらう取り組みが有効だと考えます。
また、⾔葉にできる環境を整えることも重要です。⾯接中に「こうした点についてどう感じますか?」といった具体的な質問を通じて、患者さんが問題を意識できるような⽀援も求められます。
さらに、患者さんご⾃⾝のモニタリング能⼒が⼗分でない場合が多いため、医師がそのサポートをしなければなりません。患者⾃⾝に残遺症状を観察してもらう⼀⽅で、医師側も観察、記録、変化を⾒守ることが必要です。この点を考えると、医師⾃⾝の観察姿勢や評価尺度の提供が患者さんの治療を前進させる重要な要素だと思います。
堀先生
医師が把握していない残遺症状を考えると、Emotional Bluntingは診察であまり気にされていないのかもしれません。患者さんとのコミュニケーションを通じて、隠れた症状を引き出したり、共有したりする姿勢が⼤切だと思います。
患者さんの症状が改善し、医師としては順調に回復していると感じても、ご家族が違和感を覚える場合もあります。その背景には病状、社会環境、薬の影響などさまざまな要因が考えられるため、それらを把握する必要があります。また、患者さんが話しやすい雰囲気を作ることや、医師が忙しそうに振る舞わないといった⼯夫も⽋かせないと考えています。
また、近年話題になっているMBCも有⽤だと考えます。共通の認識で症状を経時的に症状を⾒られることは治療のアドバンテージになります。今回のガイドライン改訂でも、こうした点が強調されています。患者さん⾃⾝が『この話は診察で取り上げるべきではない』と思い込んで訴えなかった症状も、MBCを⾏うことで浮き彫りになり、医師が対応できるようになると思います。MBCはこうした気付きを与えるうえで、有効な⼿段の⼀つだと感じます。
稲⽥先生
今⽇のテーマであるEmotional Bluntingについて、私⾃⾝もこれまで⼗分に気付けていなかったと実感しています。MBCの活⽤は、医師が気付けていない症状を抽出し、把握するのに⾮常に有効だと考えており、ぜひ取り組むべきだと思います。
また、精神科医は症状だけでなく、患者さんの背景や⽣活状況にも興味を持つことが多いと思います。そのため、患者さんの⽣活ぶりを丁寧に聞き取ることで、医師も患者も気付いていなかった残遺症状や違和感に気付ける可能性が⾼まるのではないでしょうか。
⼀⽅、薬物療法については注意が必要です。私は、効能が明確でない薬を『効くかもしれない』という理由でむやみに追加することには賛成できません。無効な薬を増やすことで副作⽤のリスクが⾼まる可能性があるため、薬物療法では適正使⽤を⼼掛けるべきだと常々感じています。
⾺場先生
ありがとうございます。薬物の選択については⾮常に重要で、Emotional Bluntingに関しても、残遺症状としての側⾯と薬剤の副作⽤としての側⾯の両⽅を考慮する必要があると感じました。こうした関連性を踏まえた治療戦略が今後の課題になるでしょう。
本⽇の議論では、維持期の治療において医療者が気付けなかった残遺症状や、当事者・家族が感じる影響について深く考える機会が得られました。特に、残遺症状が当事者だけではなく家族にも⼤きな影響を与えている点は⾮常に印象的でした。
こうした気付きは、次回のガイドライン改訂時にぜひ反映されていくべき重要な課題だと思います。本⽇は貴重なご意⾒をありがとうございました。